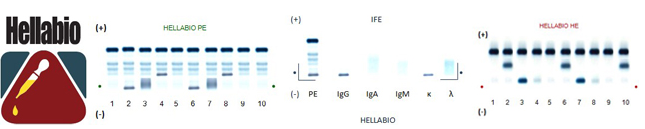
Електрофорез білків
| Код | Найменвання | Термін виконання | Ціна, грн |
|---|---|---|---|
| 11001 | Електрофорез білків сироватки крові | 3 | 700 |
Техніка електрофорезу в агарозному гелі , яка є початковою процедурою скринінгу, є дуже надійною технікою виявлення парапротеїнів у сироватці крові та інших біологічних рідинах. Це клінічно значущий метод виявлення змін сироваткового білка , пов’язаних з певними захворюваннями. Зміни в порівнянні з нормальними білковими структурами сироватки , або як наявність додаткових компонентів (моноклональних смуг), або як збільшення/зменшення нормальних компонентів, сповіщають клініциста про необхідність подальшого аналізу білка.
Електрофорез у агарозному гелі приблизно вимірює різні типи білків у сироватковій частині зразка крові. Індивідуальні білки , за винятком альбуміну, зазвичай не вимірюються електрофорезом . Проте вимірюються фракції або групи білків . Рівні білкових фракцій можна приблизно виміряти, вимірявши загальний білок у сироватці крові та помноживши на відносний відсоток кожної компонентної білкової фракції, або автоматично за допомогою HellabioScan Gel Analyzer.
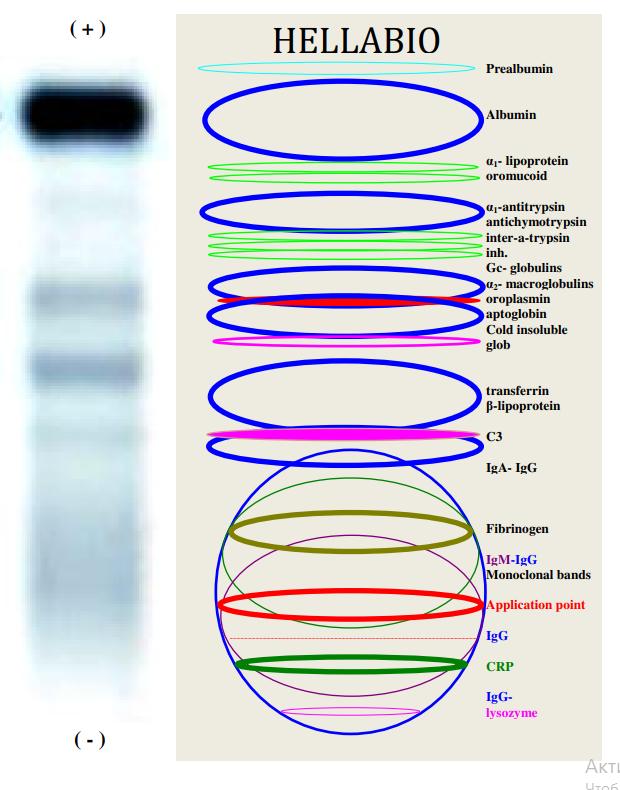
Схематичне зображення положення білків на електрофорограмі
Загальні положення про білки та білковий електрофорез
Білки сироватки крові поділяють за допомогою електрофорезу на альбуміни та глобуліни .
Альбумін є білком з найбільшою концентрацією в сироватці крові. Він переносить багато малих молекул, але також має першочергове значення для підтримки онкотичного тиску крові.
Глобуліни приблизно поділяються на альфа-1, альфа-2, бета (β1 і β2) і гамма-глобуліни. Їх можна розділити та визначити кількісно в лабораторії за допомогою електрофорезу та денситометрії.
Альфа-1 фракція включає альфа-1 антитрипсин і тироксинзв’язуючий глобулін.
Альфа-2 фракція містить гаптоглобін, церулоплазмін, ЛПВЩ і альфа-2 макроглобулін. Як правило, рівень білків альфа-1 і альфа-2 підвищується при наявності запалення.
Бета-фракція включає трансферин, плазміноген і бета-ліпопротеїни.
Гамма-фракція включає різні типи антитіл (імуноглобуліни М, G, А).
Електрофорез приблизно вимірює різні типи білка в сироватковій частині зразка крові. Індивідуальні білки , за винятком альбуміну, зазвичай не вимірюються електрофорезом . Проте вимірюються фракції або групи білків
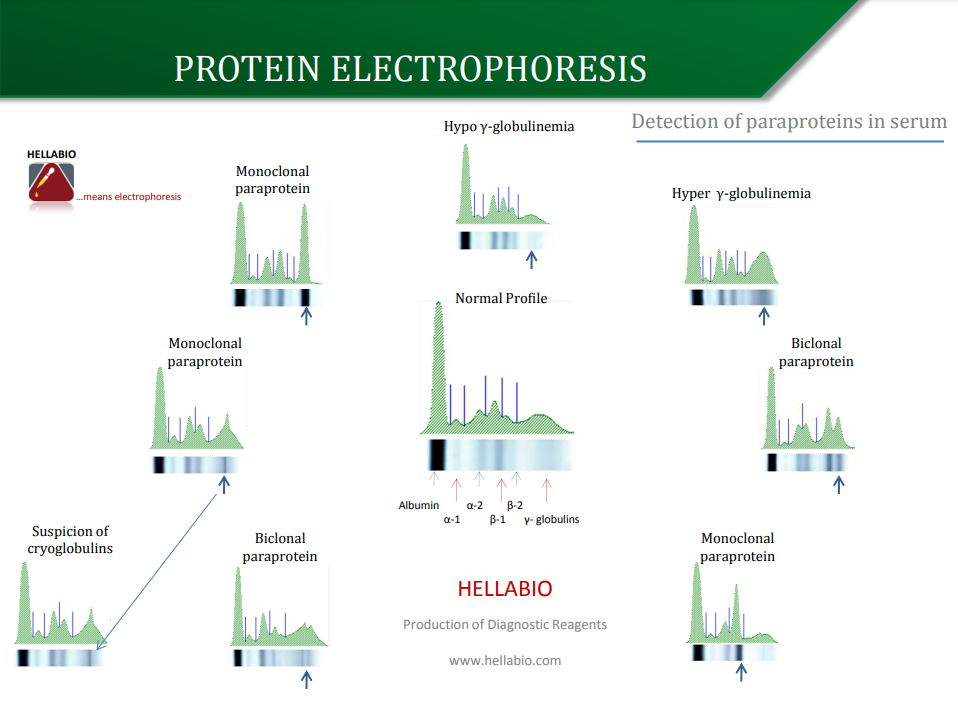
Плакат по електрофорезу білків
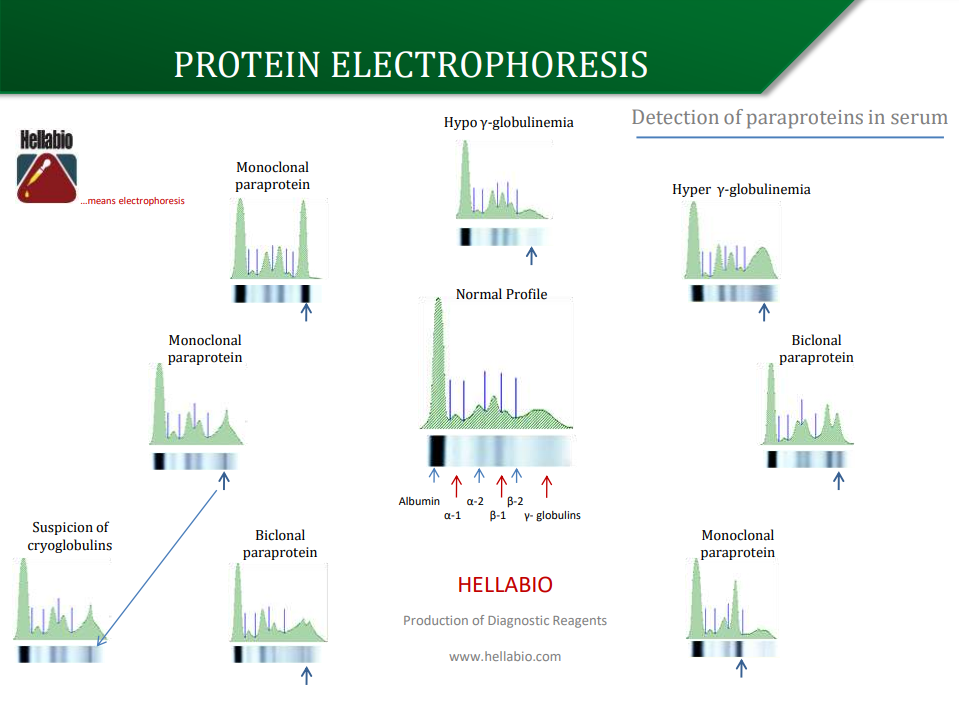
Парапротеїни
Термін парапротеїн був введений Апіцем у 1940 році для опису аномальних білків, які виробляються клітинами мієломи та зустрічаються в крові, сечі та тканинах.
Парапротеїни є найбільш ранніми описаними пухлинними маркерами і залишаються важливою частиною дослідження, діагностики та моніторингу пацієнтів з В-клітинною дискразією.
Електрофорез — єдиний надійний спосіб виявлення парапротеїну в біологічних рідинах. Цей тест є початковою процедурою скринінгу, тому він повинен мати достатню роздільну здатність для належного виконання. Електрофорез сироватки завжди повинен супроводжуватися вимірюванням концентрації IgG, IgA та IgM у сироватці крові. Зразки з підвищеними концентраціями IgA та IgM, які не можуть бути підтверджені як поліклональні методом електрофорезу, повинні бути проаналізовані за допомогою імунофіксації, щоб виключити невеликі парапротеїнові смуги, закриті однією з нормальних зон.
Більшість парапротеїнів сироватки буде знайдено в області від початку бета до кінця гамма-зон. Іноді парапротеїнові смуги з’являються в альфа-зонах і в постгамма-області.Наявність моноклональних вільних легких ланцюгів або білка Бенс-Джонса в сечі свідчить про злоякісність В-клітин і може бути єдиним маркером пухлини. Незалежно від того, яка аналітична система використовується, сліди альбуміну повинні бути видимі в кожному зразку сечі, щоб вказати на відповідну чутливість.
Виявлення парапротеїну в сироватці або сечі повинно супроводжуватися типуванням. Імунофіксація залишається методом вибору для парапротеїнового типування, оскільки він швидкий, специфічний, гнучкий і простий для інтерпретації. Він також більш чутливий, ніж електрофорез, і може виявляти парапротеїнові смуги, які не видно під час звичайного електрофорезу.
Методом вибору кількісного визначення парапротеїну є денситометричне сканування електрофорограми ( HellabioScan ). Імунохімічне кількісне визначення є ненадійним.
Виявлення парапротеїнів
Електрофорез у агарозі є найпоширенішим методом клінічної діагностики для виявлення парапротеїнів у сироватці крові та сечі. Парапротеїнові смуги можуть бути «пропущені», якщо вони мають низьку концентрацію в сироватці (<5,0 г/л) та/або якщо їх рухливість збігається з іншими смугами, такими як бета-глобуліни. Також можна пропустити парапротеїни, якщо немає пригнічення нормальної концентрації імуноглобуліну
Імунофіксацію слід проводити на зразках, якщо не виявлено явної парапротеїнової смуги, але є підвищений IgA або IgM без посиленого фарбування бета-гамма-області, що пов’язано з поліклональним підвищенням IgA або IgM. Парапротеїни IgD і вільні важкі ланцюги чутливі до постсинтетичної деградації, що призводить до появи дифузних парапротеїнових смуг під час електрофорезу. Вони можуть бути пропущені, якщо присутні в низьких концентраціях або якщо очікується побачити чітку смугу.
Існує ряд ситуацій, коли в електрофоретичному розділенні сироватки видно смугу, яка не є моноклональним імуноглобуліном; до них належать:
- додаткові смуги в альфа-1-області внаслідок алотипової варіації α-1-антитрипсину
- розщеплена альфа-2 зона через різну рухливість гаптоглобін-гемоглобінового комплексу після внутрішньосудинного гемолізу
- додаткова смуга в бета-гамма-області через високі концентрації С-реактивного білка
- додаткові смуги в швидкій гамма-області через присутність фібриногену.
- Варто також відзначити, що деякі парапротеїни випадають в осад при температурі нижче 37 o C – так звані кріопротеїни [Кріоглобуліни]. Зразки, у яких розглядається кріопротеїн, необхідно зібрати, транспортувати та відокремити при 37 o C. Якщо цього не зробити, кріопротеїн може випасти в осад, який згодом буде викинутий разом із осадом виклику.
Виявлення парапротеїніву сироватці
Кількісне визначення сироваткових парапротеїнів
Імунохімічне кількісне визначення парапротеїнів є ненадійним. Для вимірювання концентрації парапротеїну рекомендується денситометричне сканування (HellabioScan) електрофоретичного розділення гелю. Важливо знати, що між альбуміном і глобулінами існує різне зв’язування барвника, тому найточнішу оцінку парапротеїну можна отримати за відсотком відносного зв’язування барвника смуги парапротеїну порівняно із загальною фракцією глобулінів, а не загальною фракцією білок. Також важливо відзначити, що існує нелінійний зв’язок між зв’язуванням барвника та концентрацією білка при високих концентраціях парапротеїну.
Вимірювання загального білка сироватки та альбуміну, як правило, є надійним, і може бути корисним використовувати ці дві концентрації як «приблизну перевірку» кількісного визначення парапротеїну. Концентрація альбуміну, додана до концентрації парапротеїну, не може перевищувати загальну концентрацію білка, і (зважаючи на те, що може існувати диференційоване зв’язування альбуміну з глобуліном) смуги подібних ділянок повинні мати однакову концентрацію.
Кількісне визначення білка Бенс-Джонса
Кількісне визначення BJP рекомендовано як критерій відповіді, прогресування рецидиву множинної мієломи при лікуванні високими дозами терапії та трансплантації стовбурових клітин. Це має бути зроблено так само, як кількісне визначення парапротеїну сироватки, шляхом денситометрії електрофорезу сечі та розрахунку парапротеїнової смуги щодо загального білка в сечі (довільно або 24-годинно).
