
ТЕНДЕНЦІЇ РОЗВИТКУ І ПЕРЕГЛЯД ПАРАДИГМИ У СУЧАСНІЙ КОМПОНЕНТНІЙ АЛЕРГОЛОГІЇ
ГАРЄЄВ А.Л.
Виробниче підприємство «Сіместа»
Досягнення сучасної молекулярної алергології забезпечили прорив у діагностиці та лікуванні алергічних захворювань людини. На даний момент цей напрямок стрімко розвивається, постійно розширюється список відомих компонентів екстрактів алергенів, вивчаються їх характеристики і властивості. Отримана інформація оперативно систематизується, вибудовується нова групова структура білків алергенів. Проводиться об’ємна і копітка робота, і кожен новий факт, отриманий в ході останніх контрольованих клінічних досліджень, знаходить обгрунтоване місце в вже сформованої конструкції наукових уявлень про підходи до діагностики та лікування алергічних захворювань людини. Новизна результатів, отриманих у попередніх клінічних випробуваннях, зобов’язує дещо переосмислити класичні канони алергології, які досі вважаються непорушними. Ця стаття є критичним аналізом сучасної концепції алергодіагностики та алерген-специфічної імунотерапії у світлі останніх досягнень молекулярної алергології. Доводи, наведені в цій публікації, допоможуть краще зрозуміти існуючі переваги і недоліки в наукових підходах, що стосуються принципів ідентифікації причинних алергенів, підбору та розробки алергенсодержащих препаратів для специфічної десенсибілізації імунної системи пацієнта. Результати цього критичного аналізу, безумовно, розширять кругозір клініциста і сприятимуть поліпшенню якості надання медичної допомоги пацієнтам з алергічними захворюваннями.
Недоліки концепції мажорних і мінорних алергенів Як відомо, завдяки досягненням молекулярної алергології, утвердилися уявлення про мажорні і мінорні алергени. При цьому мажорні алергени високоспецифічні і містяться в продукті у великій кількості, тоді як мінорні – представлені в малих кількостях і недостатньо специфічні саме для даного продукту [1,3]. Тому при доборі алерген-специфічної імунотерапії рекомендують враховувати саме мажорні, а не мінорні алергени [2,4]. Хоча така класифікація не втратила своєї актуальності, останні відкриття в молекулярної алергології висувають нові вимоги до якості проведеної алергодіагностики.
Система поглядів мажорний/мінорний алерген не надає достатнього обсягу інформації, яка давала б можливість адекватно вивчати закономірності взаємозв’язків усередині білкових груп після розширення уявлень про гомологічність компонентів алергенів. Ці терміни носять до певної міри штучний характер, оскільки конкретні алергенні компоненти можуть виступати мажорами або мінорами в різних клінічних ситуаціях. Сенсибілізація не обов’язково здійснюється саме до мажорного компонента алергену, причому у деяких продуктів до 50% випадків сенсибілізації викликано саме мінорними алергенами, які можуть ігноруватися при підборі алергенспеціфіческой імунотерапії. Сьогодні все більшу увагу приділяють перехресним реакціям, які забезпечуються рядом типових компонентів, таких як профіліни, прокальцини або «білки-охоронці», присутніх у багатьох різнорідних продуктах, що може опосередковувати феномен полісенсибілізації та створити, на перший погляд, непереборні перешкоди при виборі ефективного препарату для специфічної десенсибілізації [5]. Парадигма «мажор – призначаємо АСІТ, мі-нор – не призначаємо АСІТ» без урахування перехресто-реагуючих компонентів алергенів та проведення спеціального аналізу в таблицях перехресно-реагуючих білкових алергенних груп – занадто спрощена схема для здійснення ефективної специфічної імунотерапії в сучасній . Прихильники такого підходу необґрунтовано звужують свій світогляд до секторальної оцінки проблем пацієнта. У поле зору такого лікаря не потрапляє оцінка можливої сенсибілізації імунної системи пацієнта до білків гомологам, і такий підхід не допомагає в кожному конкретному клінічному випадку виявляти «справжній сенсибілізатор», який може не належати до когорти зумовлених мажорних алергенів відповідно до затвердженої класифікації.
Необхідність переходу від стандартизованих екстрактних до рекомбінантних персоніфікованих алерговакцин Неспроможність парадигми «мажор-АСІТ» проявляється у відомих проблемах вибору засобу для проведення АСІТ в клінічній практиці. Занадто жорсткі правила такої концепції не дозволяють здійснювати персоніфікований підхід до пацієнта у складних клінічних випадках. До певної міри парадоксальним можна вважати рішення алерголога призначити екстрактну полікомпонентну вакцину пацієнту, у якого виявлена сенсибілізація до єдиного компоненту цього екстракту. У пацієнта з моносенсибілізацією до одного компонента алергену, при призначенні екстрактної вакцини полікомпонентного складу можна добитися небажаного формування сенсибілізації до всіх білків-компонентів, що входять в екстрактну вакцину. Так звані «балластні» для пацієнта білки при тривалому застосуванні екстрактної вакцини можуть викликати в хворому організмі нові сенсибілізації, тим самим ускладнюючи перебіг алергічної хвороби. При цьому вміст необхідного компонента, до якого власне домагаються розвитку десенсибілізації, у стандартній екстрактній вакцині може бути недостатнім саме для цього конкретного пацієнта. Змінити його зміст у контексті індивідуального підходу в більшості випадків не представляється можливим через відсутність належної гнучкості у виробників екстрактних вакцин. Тому назріла необхідність застосування нового покоління рекомбінантних алерговакцин, що містять ті компоненти алергену, до яких є сенсибілізації імунної системи даного пацієнта, і позбавлених багатьох небажаних компонентів, з якими можуть бути пов’язані побічні реакції при застосуванні препарату. У рекомбінантних вакцинах можна підібрати потрібні кількості та співвідношення компонентів алергенів, щоб досягти максимальної клінічної відповіді навіть при нестандартних ситуаціях. Саме такі препарати для АСІТ можуть забезпечити бажаний персоніфікований підхід до пацієнта в алергології за високого ступеня безпеки. Парадигма аналізу гомологічності/специфічності алергенного компонента як інновація в молекулярній алергології різних алергенних груп?
На даний момент виділено та охарактеризовано декілька хімічних груп, що опосередковують перехресні алергічні реакції між різними алергенами через гомологію у будові їх пептидів [2,3,4]. Застосування аналізу конкретного випадку алергії в системі таблиць гомологічності алергенних компонентів дозволяє виявити закономірності у розвитку алергічних реакцій до різних, різнорідним на перший погляд продуктам. У термінологічну лексику для опису взаємозв’язку між алергенними компонентами також введено поняття, протилежне гомологічності, – специфічність, яке застосовується до консервативних алергокомпонентів, що не володіє гомологічності в будові амінокислотних груп з іншими алергенами. Закономірності, про які йдеться, легко виявляються серед рослинних алергенів. Це пилок дерев, трав, бур’янів, а також овочі, фрукти, ягоди, горіхи, боби, латекс. Більше того, розібравшись на прикладі рослинних алергенів, ці принципи можна перенести на алергени тваринного походження – сироваткові альбуміни, ліпокаїни, тропоміозини, парвальбуміни і т.д. Ранжований ряд білкових груп рослинних алергенів виглядає наступним чином: CCD, Polcalcins, Profilins, PR10, nsLTP, Storage Proteins Розташування білкових груп у цьому ряді носить закономірний характер, що виражається в прогресуючому зниженні їх гомологічності і реципрокції. права право. Нижче наведені характеристики окремих груп ряду. Карбогідратна детермінанта (CCD) є додатковою конструкцією в білковій структурі найрізноманітніших рослинних алергенів. Їх просторова конфігурація і молекулярний склад настільки схожі, що, перебуваючи у складі білкових компонентів різних алергенів, вони передбачувано викликають перехресні алергічні реакції і впливають на інформативність алерготестів. Специфічні IgE, вироблені у пацієнта до ССD конкретного алергену (наприклад, Phl p 12), реагують з CCD інших алергенів (наприклад Phl p 4 , Phl p 6, Art v 1, Bet v 1 та ін.), якщо маркери цих алергенів були взяті в лабораторне тестування одночасно. Оскільки гомологічність CCD максимально виражена, це призводить до повсюдних перехресних реакцій.
Наслідуючи закономірності, про яку йдеться, згідно з серединним положенням цієї групи в ранжирі рослинних аллергенів, ступінь гомологічності білків у ній знижується, а специфічність, навпаки, суттєво наростає. Просторова структура і амінокислотний склад цих білків зберігає достатню кількість однакових або схожих між собою фрагментів, але з’являються і такі, які не повторюються в інших членів цієї білкової групи. Баланс гомологічності та специфічності компонентів алергенів настільки варіабельний у кожного конкретного пацієнта, що це повинно змушувати лікаря зосередити максимум своєї уваги до таких клінічних ситуацій. Так, утворені специфічні IgE до Art v 3 (полин), Par j 2 (постениця) можуть дати перехресну реакцію з Pru р 3 (персик) з певним ступенем ймовірності [6]. Така ймовірність досить висока, оскільки всі перелічені компоненти входять в naLTP – групу білків з високою гомологічності в амінокислотних послідовностях. Однак така гомологічність аж ніяк не абсолютна. У випадку з одним конкретним пацієнтом такий перехрест проявляє себе клінічно у вигляді феномена полісенсибілізації, а у випадку з іншим – клінічні наслідки перехреста можуть бути зовсім відсутніми. Високий ступінь гомологічності всередині груп PR10, nsLTP повинна змусити лікаря передбачити у конкретного пацієнта перехресні реакції між пилковими та харчовими алергенами та призначити відповідні лабораторні дослідження, які повною мірою продемонструють наявність перехрестів. Різноманітність і кількість таких перехрестів у конкретного пацієнта впливають на оцінку прогнозу алергічного захворювання. Чим більше перехрестів, тим важче може бути клінічна картина алергії і ширше перелік небезпечних алергенних продуктів, контакт з яким може призвести до загострення захворювання. У складі компонентів, дають перехресні реакції всередині груп PR10, nsLTP, лікар зобов’язаний виявити «справжній сенсибілізатор», тобто. білок, що дає максимальну алергію при контакті з ним.
Специфічність таких маркерів виражена мінімально. Profilins – білки з схожою просторовою структурою амінокислотних ланцюгів настільки, що виявити відмінності між молекулярними ланцюгами, наприклад, Phl p 12 (тимофіївка) і Cuc m2 (диня), що входять до групи Profilins, дуже складно. Гомологічність таких білків залишається дуже високою, а специфічність залишається на низькому рівні. Ці особливості роблять перехресні реакції всередині групи Profilins широко поширеним явищем при алергодіагностиці. Тому виявлена сенсибілізація до одного з членів групи Profilins (наприклад, Phl p12) не вимагає додаткових лабораторних досліджень для підтвердження сенсибілізації у цього ж пацієнта до Profilins інших алергенів. Така сенсибілізація обов’язково матиме місце. Polcаlcins займають середнє положення між CCD та Profilins за ступенем гомологічності та специфічності білкових груп. Ступінь гомологічності у них нижче, ніж у CCD, але більш виражена, ніж у Profilins. А специфічність, навпаки, більш виражена, ніж у CCD, і нижче, ніж у Profilins. Простежується ще одна закономірність у системі гомологічність/специфічність алергенних компонентів щодо ступеня вираженості клінічних проявів. У компонентів з високою гомологічністю клінічні прояви зазвичай мінімальні. При сенсибілізації до CCD клінічні симптоми відсутні, а при сенсибілізації до Polcаlcins та Profilins вони виявляються, як правило, у вигляді помірного кишкового синдрому без тенденції до генералізації. Застосовувати АСІТ у таких випадках часто нераціонально. Якщо лікар все ж таки приймає таке рішення через вираженість симптомів, то в групі Profilins універсальним засобом імунотерапії може виступити Phl p 12 з вираженою гомологічності до всіх членів групи Profilins. Якщо співвіднести системи поглядів мажор/мінор і гомологічність/специфічність, то можна дійти висновку, що білки з максимальною гомологічності і мінімальною специфічністю певною мірою відповідають терміну «мінори» і, що дуже важливо, вони виступають такими для всіх пацієнтів з сенсибілізацією до Polcalcins і Profilins. Найбільша увага в ході діагностичних заходів, і, тим більше, при виборі засобу АСИТ, вимагає до себе групи білків PR10 і nsLTP. \\\\Відповідно до зазначеної закономірності, такі дослідження можуть призвести до, на перший погляд, «парадоксальним» висновків. Наприклад, реакція на Art v 3 (полин), Par j 2 (постениця), виявлена на первинному етапі, може бути нижчою за інтенсивністю та по-тенціальною небезпекою для здоров’я, ніж ре-акція на Pru р 3 (персик), ідентифікована при додатковому лабораторному обстеженні згідно з таблицями гомологічності алергенних компонентів. Це дозволить вважати «справжнім сенсибілізатором» саме Pru р 3 (персик) та призначити відповідну АСІТ. У цьому випадку респіраторні симптоми, індуковані Art v 3, повинні розцінюватися як супутні, а основна проблема полягає в харчовій алергії до Pru р 3. Тому вибір АСІТ повинен бути на користь препарату на основі Pru р 3 (персик), а не Art v 3. І чим детальніше лікарю вдасться простежити можливі зв’язки між відомими представниками білкових груп PR10, nsLTP в таблицях гомологічності у конкретного пацієнта, тим більше точну діагностичну інформацію він отримає і тим ефективніше і безпечніше АСІТ може призначити. Концепція мажор/мінор не дозволяє здійснити настільки глибокий аналіз, як концепція гомологічності/спец-фічності алергенних компонентів. Білки, що входять до груп PR10, nsLTP (наприклад, Bet v 1 як представник групи PR10), для одного пацієнта можуть виявитися «мажорними», а для іншого – «мінорними», що вимагає індивідуального підходу до інтерпретації діагностичних даних у алергології, неможливого в рамках жорсткої концепції зумовлених мажорів та мінорів. Клінічні прояви алергії у пацієнтів із сенсибілізацією до білків PR10, nsLTP досить різноманітні, а тяжкість симптомів – варіабельна, оскільки є безліч видів можливих гомологічних зв’язків між членами цих груп, одна з яких може реалізуватися у конкретного пацієнта. Це наголошує на необхідності в персоналізованому підході до алергодіаг-ності в рамках концепції гомологічність/специфічність алергенних компонентів. Storage proteins – крайня справа група у ранжирі алергенних білків. При тому низькому рівні гомології, який все-таки дозволяє ці білки об’єднати в єдине ціле, ступінь специфічності у них виражена настільки сильно, що перехресні реакції між ними майже неможливі. Це дозволяє впевнено заявити, що «білки-охоронці» можуть бути лише «мажорами». Але ось питання: наскільки мінімальна гомологія всередині групи Storage proteins при сенсибілізації до Ara h 2 (арахіс) не призведе до розвитку алергічної перехресної реакції на Cor a 14 (фундук), Jug r 1 (волоський горіх), Ber e 1 (бразильський) горіх), Ana o 3 (кешью), Pis v 1 (фісташки), Ses I 1 (кун-жут) та Bra n 1 (насіння гірчиці)? Відповідь на це питання для лікаря-фахівця вкрай важлива, оскільки клінічна картина при сенсибілізації до білків Storage proteins вкрай важка, причому нерідкі випадки анафілаксії з потенційно смертельним результатом. Пацієнт із виявленою сенсибілізацією навіть до одного білка із групи Storage proteins, має бути належним чином «озброєний». При ньому завжди повинні знаходитися засоби екстреної медичної допомоги від анафілаксії. Такий пацієнт разом з лікарем повинен визначитися з харчовим раціоном, залишивши в ньому тільки ті горіхи і боби (саме тут переважно містяться Storage proteins), без яких хворий не мислить своє харчування, з подальшим лабораторним дослідженням на предмет можливої сенсибілізації до тих, що залишилися в раціоні хворого Storage proteins згідно таблиць гомологічності алергенних компонентів.
ПЕРЕХРЕСНА РЕАКТИВНІСТЬ СЕРЕД БІЛКІВ nsLTP
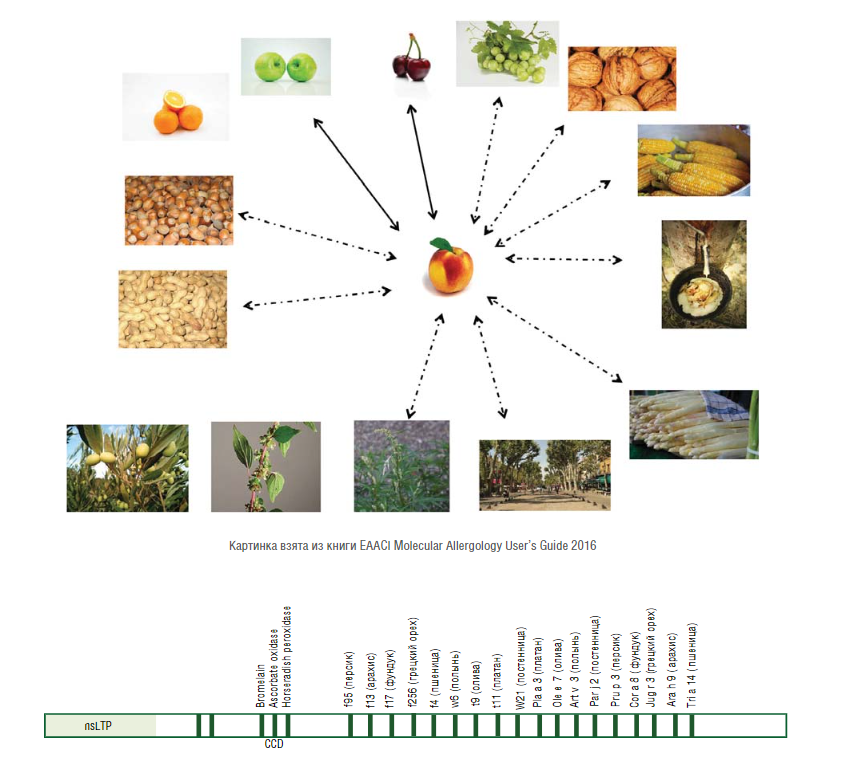
Персик є найчастішою причиною алергії на nsLTP. Сенсибілізація до Pru p 3 виступає провісником підвищеної чутливості до інших білків nsLTP. Розоцвіті – яблуко Mal d 3, слива, абрикос, вишня Pru av 3, груша входять у ближнє коло алергенів, що викликають сенсибілізацію до nsLTP. Крім того, є ботанічно не пов’язана з персиковою групою, горіхова група – волоський горіх Jug r 3, фундук Cor a 8, боби – арахіс Ara h 9, що викликають важкі системні реакції у nsLTP сенсибілізованих пацієнтів. Також злаки – пшениця Tri a 14, куку-руза Zea m 14, рис можуть викликати системні реакції у пацієнтів з nsLTP алергією. Наявність IgE антитіл, специфічних до Ole e 7, пов’язують із підвищеним ризиком розвитку аст-ми. Присутність у місцях проживання пацієнтів пилкових алергенів – Art v 3 (полин), Pla a 3 (платан), підвищує ризик розвитку астми, пов’язаної з Ole e 7. Важливо, що nsLTP овочів та фруктів здатні викликати респіраторні симптоми.
Висновок
Ця стаття є критичним аналізом стану справ у низці важливих проблем сучасної молекулярної алергології. Тут представлені як результати останніх клінічних досліджень, присвячених раціональної алергодіагностики та алерген-специфічної імунотерапії, так і деякі оригінальні погляди автора, які можуть бути корисні алергологам і клінічним імунологам в їх клінічній практиці. Необхідно ще раз підкреслити, що відомі недоліки концепції мажорних і мінорних алергенів можна значною мірою виправити, застосувавши нову концепцію гомологічності / специфічності компонентів алергенів. Такий концептуальний перехід дозволяє краще охарактеризувати коло небезпечних продуктів, контакт з якими є небажаним для даного пацієнта, та якісніше здійснити раціональне прогнозування подальшого перебігу алергічної хвороби в кожному конкретному випадку з високим ступенем достовірності. Застосування концепції гомологічність/специфічність алергенних компонентів допомагає більш точно встановити причинний алергенний агент і тим самим поліпшити якість підбору алерген-специфічної імунотерапії, уникнувши ряду типових діагностичних і пов’язаних з ними лікувальних помилок. Також назріла необхідність переходу від екстрактних полікомпонентних вакцин, що не дозволяють здійснювати раціональну персоніфіковану імунотерапію в кожному конкретному випадку через надмірну стандартизацію, до індивідуально розроблених алерговакцин рекомбінантного походження, що дозволить підвищити ефективність проведеної десенси. реакцій під час імунотерапії
СПИСОК ЛІТЕРАТУРИ
- Мітін Ю.А.Лабораторна діагностика алергічних захворювань. Методичні рекомендації. Санкт-Петербург. – 2017. – 109 с.
- Новик Г.А. Механізми алергічних реакцій та методи алергогообстеження в клінічній практиці (діагностика та диференціальний діагноз). Навчально-методичний посібник за редакцією з.д.н. РФ, професора І.М. Воронцова СПб.: Видання ДПМА. – 2004. – 76 с.
- Canonica Walter та ін. Консенсус WAO-Aria-GA LEN з молекулярної діагностики алергій https://elibrary.ru/item.asp?id=21987599
- EAACI Global Atlas Allergy. https://www.eaaci.org/globalatlas/GlobalAtlasAllergy.pdf
- EAACI Molecular Allergology User’s Guide. https://www.eaaci.org/documents/Molecular_Allergology-web.pdf
- Kleine-Tebbe J., Thillo J. Molecular allergy diagnostics з використанням IgE довжиною визначень: методологічних і практичних умов-ефектів для використання в клініці // Аллерго J. Int. – 2015. – Vol. 24. – P. 185-197.
РЕЗЮМЕ
ТЕНДЕНЦІЇ РОЗВИТКУ І ПЕРЕГЛЯД ПАРАДИГМИ У СУЧАСНІЙ КОМПОНЕНТНІЙ АЛЕРГОЛОГІЇ
Гарєєв А.Л.
Тут представлені як результати останніх клінічних досліджень, присвячених раціональній алергодіагностиці та алерген-специфічної імунотерапії, так і деякі оригінальні погляди автора, які можуть бути корисні алергологам і клінічним ім-мунологам в їх клінічній практиці. Наголошено, що відомі недоліки концепції мажорних та мінорних алергенів можна значною мірою виправити, застосувавши нову концепцію гомологічності/специфічності компонентів алергенів. Такий концептуальний перехід дозволяє краще охарактеризувати коло небезпечних продуктів, контакт з якими є небажаним для даного пацієнта, і якісніше здійснити раціональне прогнозування подальшого перебігу алергічної хвороби в кожному конкретному випадку з високим ступенем достовірності. Застосування концепції гомологічність/специфічність алергенних компонентів допомагає більш точно встановити причинний алергенний агент і тим самим покращити якість підбору алерген-специфічної імунотерапії, уникнувши ряду типових діагностичних і пов’язаних з ними лікувальних помилок. Також назріла необхідність переходу від екстрактних полікомпонентних вакцин, що не дозволяють здійснювати раціональну персоніфіковану імунотерапію в кожному конкретному випадку через надмірну стандартизацію, до індивідуально розроблених алерговакцин рекомбінантного походження, що дозволить підвищити ефективність проведеної десенсибілізації і зменшити реакцій під час імунотерапії Ключові слова: молекулярна алергологія, гомологічні алергенні компоненти, імунотерапія. важливих проблем сучасної молекулярної алер-гології. Тут представлені як результати останніх клінічних досліджень, присвячених раціональній алер-годіагностиці та аллерген-специфічній імунотерапії, так і деякі оригінальні погляди автора, які можуть бути корисні аллергологам та клінічним імунологам у їхній клінічній практикі. Підкреслено, що відомі недоліки концепції мажорних та мінорних аллергенів можна у значній мірі виправити, застосувавши нову концепцію гомологічності/специфічності компонентів алергенів. Такий концептуальний перехід дозволяє краще оха-рактеризувати коло небезпечних продуктів, контакт з якими є небажаним для даного пацієнта, і якісніше здійснити раціональне прогнозування подальшого перебігу алергічної хвороби в кожному конкретному випадку з високим ступенем достовірності. Застосування концепції гомологічність/специфічність аллергенних компонентів допомагає точніше встановити причинний аллергенний агент і тим самим покращити якість підбору препарату для аллерген-специфічної імунотерапії, уникнувши ряду типових діагностичних та пов’язаних з ними лікувальних помилок. Також назріла необхідність переходу від екстрактних полікомпонентних вакцин, які не дозволяють здійснювати раціональну персоніфіковану імунотерапію в шкірному конкретному випадку через надмірну стандартизацію, до індивідуально розроблених аллерговакцин рекомбінантного походження, що забезпечить підвищення ефективності проведеної десенсибілю. під час імуно-терапії. Ключові слова: молекулярна алергологія, гомо-логічні алергенні компоненти, імунотерапія.
SUMMARY
DEVELOPMENT TRENDS AND PARADIGM REVISION
IN MODERN COMPONENT ALLERGOLOGY
Gareev A.L.
Production enterprise “Simesta”
The achievements of modern molecular allergology have provided a breakthrough in the diagnosis and treatment of human allergic diseases. At the moment, this trend is developing rapidly, the list of known components of allergen extracts is constantly expanding, their char-acteristics and properties are being studied. The novelty of the results obtained in previous clinical trials requires several rethinking of the classic canons of allergology, which are still considered unshakable. This article is a critical analysis of the state of affairs in a number of important problems of modern molecular allergology. Here are presented both the results of recent clinical studies on rational allergy diagnosis and allergen-specific immunotherapy, as well as some of the author’s original views that may be useful for allergists and clinical immunologists in their clinical practice. The arguments presented in this publication will help to better understand the existing strengths and weaknesses in scientific approaches concerning the principles of causative allergen identification, selection and development of allergen-containing drugs for specific desensitization of the patient’s immune system. It was emphasized that the known disadvantages of the concept of major and minor allergens can be largely corrected by applying the new concept of homology/specificity of the components of allergens. Such a conceptual transition makes it possible to better characterize the circle of dangerous products, contact with which is undesirable for a given patient, and to more accurately carry out a rational prognosis of the further course of an allergic disease in each specific case with a high degree of certainty. The application of the concept of homology/specificity of allergenic components helps to more accurately determine the causative allergenic agent and thereby improve the quality of selection of allergen-specific immunotherapy, avoiding a number of typical diagnostic and therapeutic errors associated with them. Also, there is a need to move from polycomponent extract vaccines that do not allow rational personalized immuno-therapy in each case due to excessive standardization to individually developed allergic vaccines of recombinant origin, which will increase the effectiveness of desensitization and reduce the number of adverse reactions during immunotherapy. Key words: molecular allergology, homologous allergenic components, immunotherapy.
